-
-
欧盟CE认证
EU CE CERTIFICATION
- 2021-02-01
-
-
- 2020-05-28
- 2020-05-28
- 2020-05-28
- 2020-05-28
- 2020-05-28
- 2020-05-28
国际认证
INTERNATIONAL CERTIFICATION
-
- 2020-05-28
- 2020-05-28
- 2020-05-28
- 2020-05-28
- 2021-11-25
-
-
-
-
专业认证 用心服务
信誉第一,服务领先!
全国服务热线:
021-34122669

On 14 October 2021, the Commission made a proposal for a Regulation of the European Parliament and of the Council amending Regulation (EU) 2017/746 as regards transitional provisions for certain in vitro diagnostic medical devices and deferred application of requirements for in-house devices (COM(2021)627 final). The aim of the proposed Regulation, which needs to be adopted by the European Parliament and the Council, is to smooth the transition from the current Directive 98/79/EC to the new Regulation (EU) 2017/746 in order to prevent disruption in the supply of essential in vitro diagnostic medical devices.
2021年10月14日,欧盟委员会向欧洲议会和理事会提出一项法规提案,修订关于某些体外诊断医疗设备IVDR的过渡性规定和内部设备要求的延期应用的法规(EU) 2017/746 (COM(2021)627最终版)。该拟议法规需要欧洲议会和理事会通过,其目的是平稳地从当前的指令98/79/EC过渡到新的法规(EU) 2017/746,以防止必要体外诊断医疗设备供应中断。

根据欧盟官方公告:
• Date of application (26 May 2022) maintained应用日期(2022年5月26日)不变
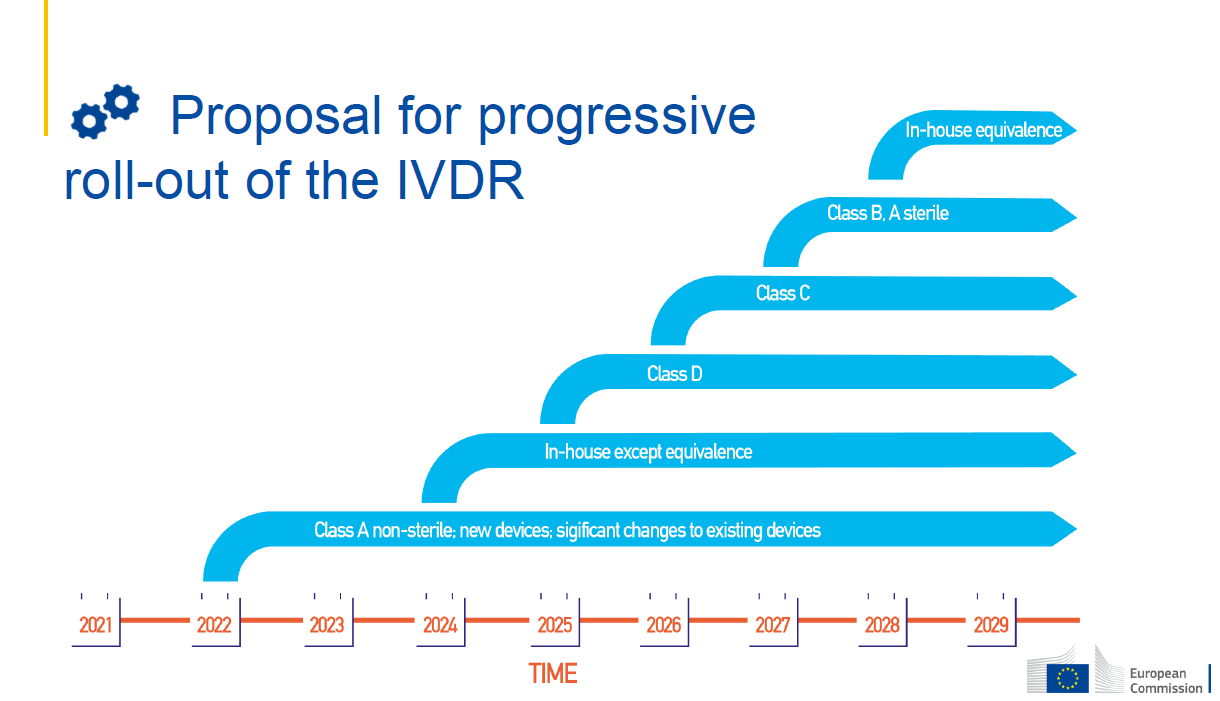
• Extension of transitional provisions (scope and timelines): 延长过渡规定(范围和时间表)
• Devices with a notified body (NB) certificate under Directive 98/79/EC and requiring NB assessment under Regulation (EU) 2017/746 (Directive 98/79/EC Annex II List A and B; self-tests) - extend transition period by 1 year until 26 May 2025
具有公告机构(NB)证书的设备,要求根据法规(EU) 2017/746进行NB评估(指令98/79/EC附件II List a和B;自检)-将过渡期延长一年,至2025年5月26日
• Devices with a Declaration of Conformity (DoC) under Directive 98/79/EC and requiring NB involvement under Regulation (EU) 2017/746 – risk-based approach根据指令98/79/EC声明合格(DoC)的设备,并根据IVDR法规(EU) 2017/746要求NB参与-基于风险的方法:
• class D – provide transition period until 26 May 2025 过渡期延长至2025年5月26日
• class C – provide transition period until 26 May 2026 过渡期延长至2026年5月26日
• class B and class A sterile – provide transition period until 26 May 2027 过渡期延长至2027年5月26日
• In-house devices, i.e. those subject to Article 5(5) of Regulation (EU) 2017/746: 内部装置,即受法规(EU) 2017/746第5(5)条约束的装置:
• maintain the exemption as under Directive 98/79/EC from 26 May 2022 根据指令98/79/EC,从2022年5月26日起保持豁免
• provide transition period until 26 May 2024 for requirements in Art. 5(5), points (b), (c), (e) – (i) 为第5(5)条(b)、(c)、(e) - (i)项规定过渡期验长至2024年5月26日
• provide transition period until 26 May 2028 for requirement in Art. 5(5), point (d) 为第5(5)条(d)点的要求过渡期验长至2028年5月26日
过渡期时间表:
以上信息来源于欧盟官网:https://ec.europa.eu/health/md_sector/new_regulations
上海郜盟,欧盟公告号机构授权代表,提供专业高效的欧盟体外诊断医疗器械IVDR,IVDD认证技术服务。
2021.10.14欧盟官方公告IVDR延期法案-IVDD过渡期延长
联系我们
友情链接:
新闻资讯
客户服务
郜盟服务
关于我们
版权所有 All Rights Reserved.
021-34126062
















